单域抗体是抗体分子的抗原结合单元,仅由一个可变结构域或一个仅协助靶标结合的工程化的恒定结构域组成。此类抗体衍生物包括来源于骆驼科和鲨鱼类动物中天然产生的可变区以及工程化的人源抗体中重链或轻链的可变区或恒定区结构域。由于其高度的亲和力、特异性以及稳定性,分子量小和拥有多种重新改构(re-formatting)机会的优势,此类分子成为生物医学应用领域中前景光明的候选者,其中一些实体已经证明在临床开发方面取得了成功。
简介:
单克隆抗体(mAb)是治疗,诊断和生物技术应用领域中不可或缺的分子。作为制药行业的主要驱动之一,就目前和预期的市场增长率而言,单克隆抗体是畅销的生物制剂类产品,大大超过了整体行业水平。其突出的临床疗效与数十种市售抗体以及数百种mAb临床开发相结合已经证明了其重要的治疗潜力。截至2014年10月,已有五种重组抗体治疗剂在2014年获得首次营销批准。此外,目前另有七个实体分子在美国或欧洲正进行第一次监管审查。然而,对于某些特殊应用,比如体内成像,传统的抗体分子可能会由于其大的异四聚体结构而减弱。慢的血液清除率,肿瘤渗透限制以及健康组织的非特异性摄取也可能为不同的应用带来问题。为解决此类问题并进而从而大力开发生物治疗和诊断的全部组合,以便为特定应用选择合适的分子,下一代抗体技术如抗体偶联药物,免疫细胞因子,抗体片段以及支架蛋白应运而生。与此相关的是,正如Dimitrov及其同事总结:抗原结合位点(antigen-binding sites)被引入人源抗体IgG的Fc片段以后,显著的降低了全长抗体分子的复杂性。Ruker 与其同事介绍,借助一个非常精妙的方法,抗原结合表位被工程化引入到CH3片段的C末端,这样可保留了Fc部分的功能,比如长的血清半衰期和抗体依赖的细胞毒作用。
除了工程化的抗体衍生物以外,骆驼科和鲨鱼科动物的免疫系统包含有一种非常规的抗体重链分子,它的抗原结合表位仅仅由一个单链区域所介导,分别被称为骆驼重链抗体的可变区(VHH)和IgNAR(vNAR)的可变区。一般来说,此类结构表现出对同源抗原的高特异性,高的物理化学稳定性以及小的分子量,因此被认为是有助于生物医学发展的前景光明的候选者。将VHH的关键元件转移到人重链(VH)结构域的可变区上导致人重链的可变区的单链化开发,称为骆驼化的人VH结构域。如今,完全由抗体重链或轻链的可变结构域组成的人单可变区抗体(domain antibodies – dAbs)的产生是完全可行的。另外,研究表明,单体人IgG衍生的恒定区如CH2和CH3可以被工程化改造为介导抗原和/或功能性FcRn结合的支架。
通常,与常规抗体相比,单域抗体对同源抗原表现出高特异性,高物理化学稳定性以及允许增强组织穿透的小分子量。易于工程化以及具有模块化形式以形成多特异性的能力以及多价结构的出现提高了其应用于生物医学领域的可能性。本综述的目的是重点在诊断和治疗应用等方面总结归纳单域抗体的独特性能。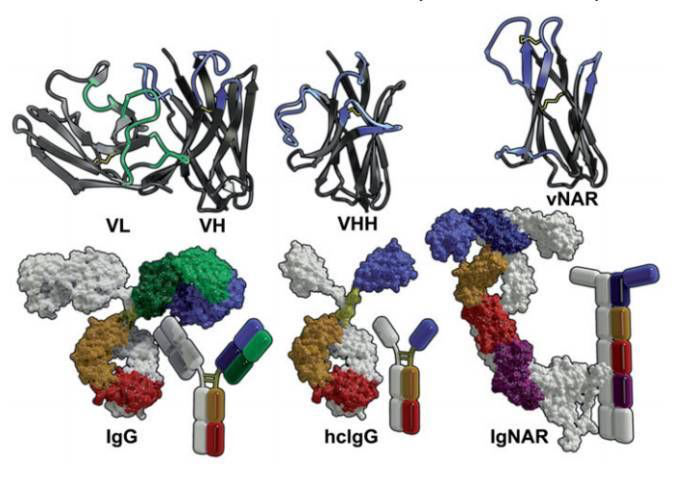
图1,抗体结构 IgG(左边PDB-ID:1IGT),骆驼hclgG(中间,由Zielonka等人的工作描述的结构),鲨鱼IgNAR(右边,模型由Michael Sattler博士和Janosch Hennig博士60慷慨提供)(顶部)彩带模型代表VL/VH, VHH以及vNAR的可变区,结合表位CDR1–3用高亮(蓝/绿)显示,以及HV2和HV4(蓝色)。二硫键用蓝色标示(下面)全长抗体的表面和示意图。 VL:浅绿色,CL:深绿色,VH / VHH / vNAR:淡蓝色,CH1 / C1:深蓝色,CH2 / C2:橙色,CH3 / C3:红色,C4:品红色,C5(假想结构)低聚物链:白色,铰链区:h色,未显示聚糖。 使用POV-Ray渲染的图(http://www.povray.org/)。 (为了解释这个图例中的颜色参考,读者参考文章的网页版本)
来源于骆驼的VHH结构
VHH结构衍生于骆驼科动物如llama和其它骆驼的免疫球蛋白家族类的包括所谓的仅含重链的抗体(HCAb)。Hamers-Casterman和他的合作伙伴在骆驼血清中发现了此类缺少轻链和CH1的抗体。在此类分子中,抗原结合区直接通过一个长的铰链区连接到Fc区域并被定义为重链抗体的可变片段(VHH)。
尽管VHH的分子量只有12~15kDa,甚至比工程化的抗体片段如Fab或单链可变结构(scFvs)都要小,但是其表现出的特异性和亲和力则与单克隆抗体相当。传统经典抗体的VH结构域和HCAb的VHH结构域的整体组织显著相似。两者都包括三个位于连接两个sheet免疫球蛋白结构域的loop区中的互补识别区域(CDRs)和连接框架1和框架3的标准二硫键。但是它们也有明显的结构差异。VHH结构域在某些情况下可形成一个凸形允许其穿过凹面或者裂缝,比如酶的活性位点,传统抗体平坦的互补表位往往难以接近此类结构。这种凸性起源于非常长的CDR3区域,借助连接CDR3与llamas,中的CDR2的起点另外的二硫键或者或在骆驼中的CDR1的末端,该结构得以稳定。此外,VHH表现出卓越的可溶性,这归咎于在框架2中四个保守的亲水残基。在常规抗体衍生的VH结构域中,骨架2中的同源残基是疏水性的并且有助于重链和轻链配对。
VHHs的重组表达的出现相对于单克隆抗体的生产而言似乎是经济的替代品。虽然常规抗体的表达需要复杂的折叠机器和适当的翻译后修饰,因此需要更高的真核表达宿主,而VHHs在原核宿主如大肠杆菌中能够很容易的以每升2到3mg的水平表达。然而,需要说明的是,经典的IgG抗体可以在哺乳动物生产宿主中以克级每升水平的规模生产,并且与下游加工商品成本有关,“总体货币效益”可能被质疑。
由于翻译后修饰机制的缺失,VHH的小尺寸和稳定的单域结构允许其方便借助常见的技术平台(如噬菌体,酵母,核糖体或细菌展示)进行蛋白质工程改造。一个广泛使用获取高亲和力抗体分子的策略是:用相应抗原免疫骆驼,随后利用其外周血单核细胞构建文库,进行选择和筛选。然而,针对几个靶点的结合物,也可以使用天然或合成的VHH文库获得。至于VHH的生物医学应用,由于与人重链可变结构域的高序列相似性,大约有个氨基10氨基酸的不同,预期免疫原性较低。进一步降低免疫原性风险的尝试导致了一般的人源化策略。因此,为产生稳定的人源化VHH支架,同时保留其抗原亲和力和特异性,允许从其他VHH移植抗原结合loop。
VHH的多种的潜在的生物医学应用已经在很多文献中被详细介绍。然而,在接下来的章节中我们将重点介绍几种不同的治疗和诊断应用。虽然迄今为止,并没有基于VHH的治疗方法被批准入市,但是已经有6项研究已经推进到了临床I期或者II期实验阶段。
流行的术语“纳米抗体”作为属于商业生物制药公司Ablynx(www.ablynx.com)的VHH的商品名称,目前该公司是用于生物医学应用的VHH的发展的主要驱动力量。
一项基于人源化的二价Fc融合纳米抗体Caplacizumab (ALX-0681)用于治疗罕见但是致命的血栓性血小板减少性紫癜治疗的二期临床实验研究已经完成Caplacizumab中和裸露的超大型von Willebrand因子(vWF)的A1结构域,因此阻止ulvWF和血小板上的GpIb-IX-V受体间的相互作用。在TPP病人体内,ulvWF / GpIb-IX-V相互作用导致血小板聚集过多。
另一种构建是用于治疗类风湿性关节炎的三聚双特异性纳米抗体Ozoralizumab(ATN-103)。Ozoralizumab包括两个直接拮抗TNF的VHHs和一个用于延长药物血清半衰期的靶向白蛋白的VHH。与阿达木单抗,依那西普和英夫利西单抗等现有疗法相比,其优势是更好的疗效以及低的制造成本。Ozoralizumab的临床二期实验以及一项开放标签的扩展实验已经进行,评估期长期安全性,耐受性以及多个爬坡剂量的药代动力学性质。
其它一些临床阶段前景不错的纳米抗体分别靶向IL6 (ALX-0061), IL17 (ALX-0761), RSV (ALX-0171) 以及RANKL (ALX-0141). 此外,VHH对于解决困难的靶标(例如G蛋白偶联受体)也颇有引力。在此方面,GPCRs的隐蔽表位隐藏在期跨膜区中,单克隆抗体难以接近,鉴于此,小分子化合物常用于此类GPCR靶标。正对两个GPCR(CXCR442和CXCR743),利用纳米抗体的方法对其进行靶向研究做了分别介绍。
除了作为潜在治疗使用之外,研究表明,VHHs在诊断应用中也是敏感探针。在HIV的诊断应用领域,一个靶向人血糖蛋白A的VHH被开发并与P24(HIV衣壳蛋白)进行融合。当融合蛋白被加入到HIV阳性供体的血清中以后,在抗p24抗体存在下的条件下,红细胞交联引起血液快速凝集。
在诊断中使用VHH的另一种方法是检测流感H5N1,其以夹心ELISA形式被证实。与使用单克隆抗体的市售诊断试剂盒相比,该测定提供了检测的下限。此外,同位素标记的VHH也已经用于肿瘤成像领域。在临床前验证中,靶向巨噬细胞甘露糖受体的99mTC标记的纳米抗体在肿瘤相关巨噬细胞(TAM)中持续上调,导致了有效的体内靶向与成像,有望称为肿瘤诊断的新方法!
衍生于鲨鱼的vNAR结构域
除了具有重链和轻链组成传统抗体之外,鲨鱼产生只有同种型的重链,简称Ig新抗原受体(IgNAR)。IgNAR是同型二聚体,其中每条链由五个恒定结构域组成,其后是仅促进与抗原结合的可变结构域(vNAR,IgNAR V),(图1右侧)。IgNAR (IgNAR V 结构域)的可变区展示出数个特征,明确的将其与骆驼VHH结构域区分。由于在框架2-CDR2区域中的删除,b-三明治折叠仅为8个而不是10个b链,使得vNAR结构域成为迄今为止,在已知的动物界中的与抗原结合的抗体样结构域,其分子量约为12kDa因此,IgNAR V结构域仅具有两个互补决定区CDR1和CDR3然而,在CDR2截断位点,剩余的表面暴露环形成“带状”结构,并且显示在抗原接触之后,体细胞突变的高比率也发生在该循环中,并且在对应于 HV4在T细胞受体中,vNAR结构域显示出结构相似性。因此,这些区域分别被称为HV2和HV4。
有趣的是,我们的团队已经发现,通过将HV2与酵母表面展示随机化结合,该表面暴露环可以以其作为自主性对映体的方式进行工程化,仅仅促进抗原结合。这项工作可能为双特异性vNAR结构域的构建铺平道路,这代表着迄今为止已知的双特异性抗体单位。
基于在经典抗体结构域中没有发现的非规范二硫键的数目和模式进行分类,存在几种不同类型的vNAR分子,因此,不同类型的vNAR结构域形成了非常多样化的其它的二硫桥。因此,抗原特异性克隆可以从前所未有的不同环结构的库中选出。此外,这些鲨鱼抗体结构域的互补体的结构似乎倾向于靶向抗原的裂缝,而这些凹陷表位通常对于常规抗体来说是不具备免疫原性的。事实上,研究已经表明,vNAR结构域可以靶向酶或者裂缝的活性部位。我们的小组发表了一个更为全面的综述,在IgNAR V结构域的序列水平上解决了不同类型的IgNAR V域以及其产生巨大的多样性的产生问题。
除了如前所述的小分子量以及重要的结构特征,相比传统抗体结构域,其超级稳定性和耐不可逆变性使vNAR结构成为临床开发的有前景的候选物。已经成功地表明,存在多种机会对vNAR结构域进行重构和工程化,包括单体,二聚体和三聚体构建体以及基于Fc的形式,清楚地表明了利用这些分子用于多种不同应用的可能性。因此,针对广泛的疾病相关抗原如病毒,毒素,细胞因子以及涉及肿瘤和炎症相关的靶点特异性的vNAR分子已经被分离。总而言之,当需要更高的亲和力,多种方法已经被建立以用于分离的抗原结合分子的亲和力的优化。
然而,与已经在早期临床试验中被证明成功的骆驼的VHHs不同,用于临床应用的vNAR域的研发进展正处于早期阶段。可能部分原因可解释为,与具有哺乳动物可变结构域的鲨鱼vNAR结构域的低同源性以及由此产生的潜在的免疫原性。IgNAR V结构域与哺乳动物的VH区域的序列同源性低至25%。根据Kovalenko等描述,即使在鲨鱼vNAR结构域人源化以后,大量的非CDR残基仍然是非人源的。与此相反,VHHs与人VH的序列同源性非常高,仅仅有10个氨基酸的差别,业已证明,VHHs的人源化可以很简单的通过loop grafting获得。
尽管如此,已知即使人源化和完全人的抗体,例如阿达木单抗也能够显着诱导免疫原性,基本上证明需要对每个单独的治疗候选物进行检查,这些蛋白质如何在注射到患者在临床试验范围内。
人源抗体可变区
迄今为止,来源于常规抗体的人源抗体可变区,并保留抗原结合能力的片段其大小在11和15kDa之间。这些抗体类型包括抗体重链或者轻链可变片段,并且包含介导特异性抗原相互作用的三个CDR区域。在其结构中,人类dAb与常规抗体中配对的可变片段的结构非常相似。与骆驼和鲨鱼中自然演化的对应结构相反,早期的研究认为,单链人VH结构域倾向于聚集并表现出差的溶解性,这是由于相互作用的VL结构域缺失情况下疏水性残基的溶剂暴露引起的。
此类不利特性可通过多种突变方法得以解决,并且初步尝试是将旨在介导抗体聚集阻力区域与骆驼VHH良好溶解性的关键元件移植。一个名为“骆驼化”的过程被建立,其中VL界面的残基被VHH中保守的亲水残基取代。此外,我们还清楚,CDR的组成和长度是聚集倾向的决定性因素,并且通过CDR3长度的扩展显示出对VH dAb的溶解度的积极影响。所有的这些研究指出,dAb框架和CDRs上的残基是优异的生物物理学性质的关键成分,并为库应用的脚手架蛋白工程化提供了指导。
如今,使用分子进化方法(例如噬菌体展示)以及天然或合成的人VH或VL dAb的所有组成成分,具有所需性质和特异性的人dAb的快捷生成已经实现。然而,大多数人类dAb亲合剂已经从通常用工程化支架蛋白和基于CDR的多样性构建的合成文库中分离出来了。对于抗体库构建,业已证明,有几个人种系家族(human germline families)表现出卓越的生物物理学性质,因此被认为是理想的脚手架元件。与VH结构相比,VL结构域通常似乎具有较高的抗多聚能力。VH dAb的另一个来源是仅具有人重链的转基因小鼠。然而,该平台必须通过稳定的高亲和力的结合物的产生来得以验证。
在筛选过程中需要考虑其聚集性质,几种通过噬菌体展示进行亲和力选择的方案已经建立。 在Jespers及其同事们的研究中,通过在蛋白A的淘选中应用热变性条件来选择抗聚集性dAb,从而导致具有可逆折叠性质的突变体的富集。与此类似,Famm及其同事建立了酸变性方法,热力学稳定和抗聚集的dAb因此得以被淘选。
在生物医学应用方面,与骆驼和鲨鱼的同类相比,人来源的结构域抗体的免疫原性较低,这在长期临床应用或系统性给药方面尤为重要。虽然有几个dAbs已经基于治疗应用被开发,但是迄今为止,还没有dAbs在临床三期试验中测试或批准临床应用。
有几个与治疗性应用相关的人类dAb实例在以下部分中被描述。 然而,我们并不打算提供所有早期和晚期治疗的完整列表。与解决治疗应用的一系列研究相反,诊断应用在文献中的代表性不足。
由GSK/Domantis研发的几个dAbs已经在临床一期试验中得到了评估。目前已经披露的靶点包括:TNF受体1 (TNFR1) (GSK2862277 以及其后继药物 GSK1995057),人白蛋白(GSK2374697,一个靶向exendin-4的dAb与白蛋白的基因融合蛋白)和IL-1受体。尽管已经提出dAb具有低免疫原性,但是在抗TNFR1 GSK199505799的开发期间,发现了一种新型的预先存在的抗药物抗体。本文中,在体外测定中,完全人源化的VH dAb的框架序列的自身抗体结合触发TNFR1的激活,在一些药物受试者体内发现了细胞因子释放现象GSK2374697的开发针对II型糖尿病的治疗,其结构包括用于延长半衰期的靶向人白蛋白的VH dAb从而延长艾塞那肽-4连接器对胰高血糖素样肽-1(GLP-1)受体的激动作用。
由Teva/Cephalon研发的一个二价结构(CEP-37247/ART621)包括一个Fc部分,一个截短的CH1结构和两个靶向TNF的VL dAbs。然而,针对类风湿性关节炎的临床研究在II期试验之后停止。
Chen和他的同事在一项临床前研究中发布了一个基于dAb的双特异性的多价分子。在文章中,将工程化的HIV-1抑制剂(mD1.22)与靶向HIV-1包膜糖蛋白gp120的共同受体结合位点的人dAb(m36.4)组合。通过使用人Fc片段作为支架,产生具有不同数量的结合实体的若干构型。与市售的基准抗体VRC01 103相比,这些多价蛋白对不同亚型的HIV-1病毒表现出提高的中和活性,有几个靶向与癌症相关的靶点的人dAbs抗体已经发表。Feng和他的同事分离出一个高亲和力的VH dAb (HN3)靶向构象依赖性的磷脂酰肌醇蛋白聚糖-3(GPC3)中的表位。HN3为一个二价的融合蛋白,试验证明其能够靶向几个肝细胞癌(HCC)的细胞株并能够特异性的抑制其增殖。此外,HN3还通过诱导相关信号传导的细胞周期阻滞来抑制异种移植肿瘤模型中的肿瘤生长。其他与癌症相关的靶点已经发表,包括靶向IGF-II(m630.3),SD1或IV型胶原酶用于肿瘤靶向治疗。另一个靶向CD28的人VL dAb在临床前研究中被测试用于自身免疫性疾病的治疗。通过抑制食蟹猴中T细胞依赖性Ab反应而不介导细胞因子释放或T细胞消耗显示了PEG化的VL dAb的药效学活性。
工程化的单体人IgG1 CH2和CH3结构作为支架蛋白
近年来,另一类传.抗体衍生的单结构域已经被引入作为支架蛋白应用,包括工程化的CH2和CH3结构域。由于能够与FcRn受体功能性结合,此类工程化的蛋白结构域显著的特征就是其长的半衰期。然而,似乎衍生于CH2的工程化结构具有高的多聚倾向。CH2结构域的反向平行β链结构类似于包含三个环(BC,DE和FG)的人VH结构域,其中N末端的BC和FG环可用于多样化改造。一个CH2变体(m01s),通过在A和G链之间引入额外的域内二硫键桥接并消除几个N末端残基来改造,与野生型CH2相反,m01s变体显示明显的热稳定性,良好的表达产量和高溶解度。与非FcRn相互作用的相似尺寸的支架结构相比,注射m01s的小鼠体内研究显示与FcRn相互作用的结构具有较长的半衰期。此外,通过将人VH CDR3多样性谱系移植到FG环中,并且诱变BC和DE环,m01s也被用于噬菌体文库的构建。一个突变体(m2a1)被分离,研究显示,该变体与来源HIV-1膜近端外部区域(MPER)sp62选择性结合,与FcRn受体功能性结合。
此外,近来单体可溶性CH3结构域(mCH3)也得以开发。以结构为指导的突变方法使CH3二聚体界面中的四个残基被识别,显示其对于产生单体CH3结构域至关重要。
此外,通过掺入二硫键增加了热稳定性(Tm值从40.6提高到76℃)。尽管如此,mCH3能够以pH依赖的方式结合FcRn。无论如何,与野生型Fc相比,其检测的亲和力较低。
这归因于缺乏CH2结构域,因为IgG1中CH2和CH3的残基一起负责FcRn相互作用。在这个概念验证研究中,HIV-1中和dAb m36.4作为与mCH3(m36.4-mCH3)的融合蛋白产生。M36.4靶向HIV病毒的包膜糖蛋白的表位,似乎只能通过小的分子与该表位充分的接触。虽然二聚体CH3和Fc融合蛋白的可测量的中和活性没有获得,但m36.4-mCH3表现出强烈的中和能力。在这项研究中,开发了一种新的支架蛋白,其可以用做小的抗原结合结构域的融合配体,由于FcRn受体介导的回收,该结构具有良好的组织渗透型与预期的体内长期血清半衰期。
结论
近来,单域抗体已经拓宽了治疗性和诊断性蛋白的应用领域。通过将鲨鱼,骆驼和人类的全长抗体的复杂结构分解为单个功能片段或单位,获得了新的认识。这些单一结构域可以被重塑,改造和重新组装以产生具有所需性质和特异性的新型抗体样分子,其由相同或不同功能的多个单位组成,例如三聚双特异性纳米抗体纳扎利珠单抗(ATN-103),包括两个靶向TNF的VHHs和另一个结合白蛋白的VHH。由于它们体积小,独特的结构和paratopes的性质,一些传统抗体的缺点,比如,慢的血液清除率,实体瘤的渗透受限,健康组织的非特异性摄入,凹陷表位的不可接触性都可以借助单域抗体技术来解决。特别是,vNARs和VHH是能够靶向传统抗体不能接触的表位,如酶的活性位点。
通常,工程化的抗体片段以高的亲和力保留其特异位点的结合特性,另外由于其小尺寸,具有提高的组织穿透性。对于一些诊断型应用,以体内肿瘤成像为例,单结构域抗的快速血液清除率是需要的,然而就治疗性应用而言,则需要长的血清半衰期。多种方法已经用于延长单域抗体的半衰期,比如PEG化修饰,白蛋白结合以及以Fc融合的形式便于FcRn结合。
在相对较短的时间内,可以针对各种治疗相关靶点产生具有优异物理化学属性的单域抗体。由于临床I期和II期候选抗体已被评估,可以预测的是,单域抗体将在十年内进入临床应用。






