摘要:
骆驼血清包含常规异四聚体抗体和仅有重链的HCAb抗体。这些HCAb包含VHH区和两个恒定区。HCAb之所以没有轻链是由于缺乏和轻链互作的前端VHH和第一个恒定区。尽管HCAb的基因元件已经研究清晰,但是这些专有的基因在体内如何形成结合特定抗原的抗体并完成亲和力成熟的具体机制仍未知。目前,通过鉴定识别特定抗原的VHH以及基于多种晶体结构数据总结出单域抗体具备一些有利的生化和经济特性(如大小、亲和力、特异性、稳定性和生产成本),进而推动了这些单域抗体工程化应用于实验研究、生物技术和医学。
1、简介
免疫球蛋白抗体IgG总体上的由两条相同的重链和两条相同的轻链组装而成(图1)。轻链包含两个结构域,重链包含四个结构域。抗体的轻链和重链N端的可变区VL和VH是不同的,VH-VL的不同构成了抗体识别抗原的多样性。抗体轻链和重链的恒定区CL和CH是保守的。重链剩余的两个CH可以招募如巨噬细胞和自然杀伤性细胞的免疫细胞或引起补体激活的效应功能。
骆驼的血清中有与常规免疫球蛋白不同的只有重链的HCAbs抗体。HCAbs缺失了轻链以及重链的CH1(图1)。HCAbs的重链同源二聚体可变区称为VHH的结构和功能与IgG的Fab类似。
骆驼科家族包括骆驼(单峰Camelus dromedaries 和双峰Camelus bactrianus), 美洲驼(Lama glama 和Lama guanicoe), and 小羊驼(Vicugna vicugna 和Vicugna pacos)。骆驼是胼足亚目现存的家族,胼足亚目、反刍动物(牛、山羊、绵羊、羚羊等)和羊蹄目(猪和河马)共同构成偶蹄目。虽然所有骆驼族的血清都有HCAbs,其他偶蹄目如羊蹄目和反刍动物没有功能性的HCAbs。但是在病理性疾病的病人血清和小鼠杂交瘤中发现存在基因缺失的VH和CH1的HCAbs,这些HCAbs由于缺失VH和CH1而不能与抗原结合。值得一提的是缺失轻链和CH1会导致大斑猫鲨、须鲨和斑点鼠鱼的发生。这些称为Ig-NAR的HCAbs抗体有识别抗原的V-NAR区。虽然V-NAR与骆驼HCAbs的可变区是不同的,但是他们显示出惊人的结构和趋同进化。
由于HCAbs只有一种可变区,所以骆驼被免疫后,克隆血液中循环的B细胞再通过噬菌体展示可以直接鉴定与特定抗原结合的VHHs。VHH由于相对分子质量小又称为纳米抗体或单域抗体。这篇综述里我们总结了HCAbs和VHH的主要结果特征并且更新了骆驼中可能产生HCAbs的机制。此外,我们还综述了纳米抗体广泛应用于实验研究、生物科技和医疗方面的生化基础。
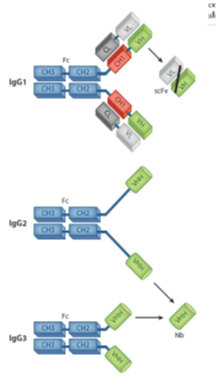
图1 Schematic representation of naturally occurringantibodies in sera of camelids
2、HCAb和纳米抗体的结构特征-骆驼族中HCAbs的亚型
2.1 重链抗体和纳米抗体
HCAbs缺失轻链和CH1区是其区别于IgG的显著特征。因此,HCAbs的大小约为90KD小于150KD的IgG。HCAbs更紧凑的结构可能使其更容易接触到隐藏的抗原。相反地,一个HCAb中两个VH相距较近可能使其可以交联抗原,虽然推测IgG2由于铰链区存在脯氨酸-谷氨酰胺重复序列形成类似于CH1的间距。
骆驼血清中HCAbs在IgG中的比例一般为50-80%,但是在北美的一些骆驼品种中,HCAbs的比例为10-25%。这说明HCAbs在骆驼的免疫中有重要作用。骆驼循环的血液中存在一些缺失轻链的IgG亚型,但是由于难以纯化得到均匀一致的亚型以及区别不同的亚型以致于不能得到全部的IgG亚型。通过Protein G和Protein A亲和层析的方法可以区分异四聚体和同二聚体。常规的异四聚体可以从Protein G柱子在低PH条件下洗脱下来,单峰骆驼不结合Protein G但是结合Protein A的IgG经控制pH可以将IgG2a和IgG2b分别洗脱下来。研究者发现这些IgG中可能含有其他IgG亚型。通过这种方法发现llama血清中有两种异四聚体亚型,并且可能存在三种IgG2和两种IgG3亚型。
通过分析单峰骆驼B细胞中的IgG cDNA发现其存在两种常规IgG亚型,HCAbs有很多种亚型。多种cDNA序列仍需进一步鉴定并区分亚型。牛中有三种IgG亚型,猪中有六种IgG亚型,这些IgG亚型不能通过Protein A或Protein G亲和层析的方法分开。
人和小鼠抗体的研究证实了并区分了IgG的亚型的功能。虽然骆驼中IgG的确切的角色和功能研究还处于初期,未感染或者免疫的动物会产生三种IgG亚型(在不同动物中会不同,取决于免疫原)。在llama中很明显的是IgG1和IgG3可以中和西尼罗河病毒,而IgG2在这方面的作用很弱。但是这三种亚型的IgG都已结合单核细胞和巨噬细胞,说明它们都可以招募免疫细胞。
2.2 VHH的结构
V区多样性的序列存在于高变区HV中,HV周围是更保守的FR区图2。V区折叠结构含有9个β折叠(A-B-C-C’-C’’-D-E-F-G)即A-B-C-C’通过loop以及与Cys23和Cys94之间的二硫键与C’’-D-E-F-G构成,HV区由B-C, C’-C’’, F-G形成的H1-H3三个loop构成。N端连续的结构形成与抗原表位互补的称为互补决定区CDR。虽然loop的序列是多变的,但是除了H3之外其余loop的长度是比较保守的。H1和H2中的Cα处在固定的位置。很明显,在人和鼠的VH结构中没有所谓经典同意的loop结构,loop结构的组合是有限的。因此,Loop的长度和关键氨基酸就可以预测其实际的结构。常规的抗体有并列的各有三个VH loop的VH和VL形成600–900埃的平台。总的来说,常规的抗体形成空腔、凹槽或平面(个别氨基酸有轻微波动酸侧链伸出)分别识别小分子、线性肽段和如蛋白等比较大的抗原。
氨基酸序列比对发现VHH与VH的FR和HV区高度相似,只在FR2和CDR区有一些不同。在FR2中,VH中与VL相互作用的重要疏水氨基酸Val47, Gly49, Leu50, Trp52在VHH中被更小的或亲水的氨基酸Phe42, Glu49, Arg50, Gly52取代。小鼠的VL缺失会造成抗体的粘性增加,而将其VH的FR2中的氨基酸替换成骆驼VHH的氨基酸则会增加抗体的可溶性。但是,这种改造会造成实际的二聚体结构变化。值得一提的是将单链可变区ScFv中前端的VH和VL进行突变被用作筛选的解决办法(如表达、聚合状体和热稳定性)。氨基酸被替换成VHH中的氨基酸的方法不等同于骆驼自然形成的VHH。这说明生物体通过众多可能的组合中选择出了有功能的VHH。虽然V-NAR和VHH的序列很多样,但是在VL中极性和带电氨基酸证实了抗原结合区域进化的不同。
VH与VHH第二个不同点在于HV的loops:因为骆驼中VHH识别抗原不需要VL,仅需要三个loop而不是常规抗体的6个loop。VHH中的loop更长以形成充分与抗原结合的600-800埃的表面。这一点通过氨基酸序列比对就可以清晰的看出H1loop中HV区和H3loop的延伸(图2)。增大的HV loop1基因可以在胚系基因中找到,但是增长的H3 loop可能是功能性VHH经V-D-J重组后选择而来的。增大的loop意味着更大的灵活性,在结合抗原时会造成熵反作用。在骆驼的VHHs中通过脱盐键约束了增长的loop,进而减少了熵值。实际上,许多骆驼的VHH H1和H3 loop中有增多的可以形成脱盐键的半胱氨酸(图2),从而可以在没有结合抗原时限制loop的灵活性。而美洲驼的VHH中额外增多的脱盐键存在的频率小,但是H3 loop的平均长度小于单峰骆驼的VHH。单峰骆驼中的脱盐键主要分布在H1和H3 loop中,但是也有一小部分约10%的VHHs的脱盐键也出现在H3和FR2之间第50的位置处。鲨鱼中的V-NARs也进化出相当数量的脱盐键将结合抗原的loops栓在一起。美洲驼和一些单峰骆驼的VHHs在H2 loop和H3 loop中也有脱盐键。虽然H1 loop中的半胱氨酸限制在30,32,33(FR2中的50或H2中的55),H3 loop 中的半胱氨酸分布在H3 loopN端、中间、C端几乎所有可能的位置处。有些VHHs的H3 loop有向外延伸的结构,主要存在于在42位置处有酪氨酸或者H3 loop比一般的短的VHHs中。VHH中存在Phe42的情况下,H3 loop会形成一个拉伸扭曲转的特殊结构,环的底部是扭曲的,尖端向C’折叠。在这种构象中,Phe42被H3 loop隐藏而无法与水接触(图2)。Trp118(FR4),Tyr(FR3)以及Phe117或Tyr117可能起到稳定H3 loop的作用。
VHH扁长的结构形成凸出的结合部位,这种结构利于其插入抗原表面形成的腔。这种结合增加了抗体结合部位实际互作的表面。长的H3序列形成一个突出的loop;但是,也有例外,如许多Nb的结构形成扁平的表面。在V-NAR中,在D-E折叠处形成的HV4有可以结合抗原,但是VHH的HV4结合抗原的能力很有限。相反,H1 loop延伸出的N端参与了抗原识别。综上,抗体结合部位的结构可形成突出的或扁平的结构,而且可以看到形成的抗半抗原腔。
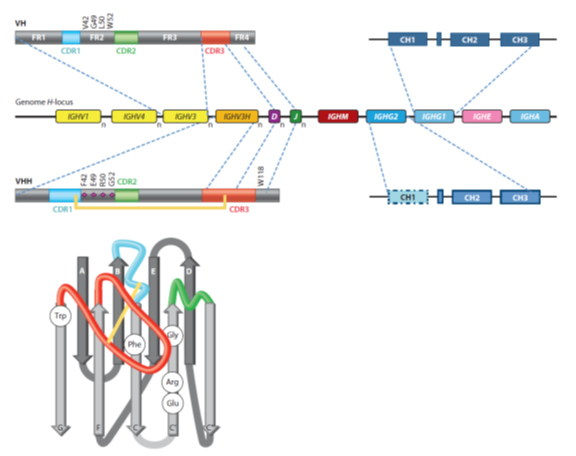
图2 Schematic representation of the H locus in the genome of camelids, which consists of several variants of the IGHV1,IGHV4, IGHV3,and IGHV3H genes upstream;
3、重链抗体特有的基因
3.1 骆驼中H Locus的组装
人和鼠的H locus包含许多处于保守的免疫球蛋白基因IGHM, IGHD, IGHG, IGHE和IGHA上游的V,D和JH元件,虽然单倍体中这些基因的拷贝数在不同动物中会有差异。骆驼中产生常规抗体和HCAb抗体的重链基因位于同一locus(图2)。单峰骆驼和羊驼的IGHG基因产生HCAbs。因此,一些IGHG基因是只有常规抗体产生中用到的,而HCAbs会用到不同的IGHG基因。与常规抗体的IGHG基因不同,这些基因产生完全相同用来产生分泌型的或膜结合的IgG分子的外显子,内含子,切换区域以及可替代性的多腺苷酸位点。CH1外显子的核酸序列是嵌入的;但是,这个区域在由于破环了CH1 N端的GT,G突变为A,因此被剪切。很可能这种剪切在骆驼中不需要特有的剪切因子,单峰骆驼的IGHG2a基因被VHH-D-J基因上游启动子替换为NSO小鼠xibao系或转基因小鼠是可以剪切CH1而产生在培养上清或血清中有功能的HCAbs。但是,将单峰骆驼IGHG2和IGHG3的CH1突变却不能产生有功能的HCAbs。HCAbs的产生可能需要CH1外显子全部切除。这一点可能说明CH1其他的氨基酸对于CH1的剪切起作用。分析单峰骆驼发现可能存在在HCAb形成中起作用的IGHG基因。
羊驼中可能只存在一种IGHM基因可以切除CH1。而且cDNA测序发现重排的VH-D-J和VHH-D-J区域包含CH1外显子序列。
3.2 VHH基因专有的 H locus
骆驼家族基因组也有VHH胚系基因(IGHVH)散布于常规抗体VH胚系基因中(IGHV)(图2)。IGHV和IGHVH基因由于分别编码显著不同的FR2而很好辨认。单峰骆驼基因组包含50IGHV基因和40IGHVH基因,但是羊驼含有71IGHV和17IGHVH基因。在B细胞形成中,IGHV或IGHVH基因参与V-D-J重排编码为VH或VHH。因为VHs和VHHs共用D和J基因,但是VHHs却形成更长的H3 loop,可能的解释是:(a)V-D-J重排时更强的脱氧核酸转移酶活性,但是这将意味着部分B细胞被区分以产生HCAbs;(b)B细胞受体被选择以确保V-D-J重排后形成特定的V结构;(c)含有较短H3 loop的VHH由于不能形成与抗原结合的更大的结合表面而被淘汰。有趣的是,IGHVH基因在CDR1的半胱氨酸密码子处或单峰骆驼(FR2 50)及羊驼Cys55不同于IGHV区。
H3 loop中第二个半胱氨酸密码子出现在V-D-J重排后或之后的体细胞超突变。显然的是,B细胞中V-D-J产物中只有一个Cys密码子将被淘汰如果这一Cys没有被取代或者没有形成第二个Cys密码子。如果只有一个Cys将会导致VHH二聚体的形成从而不能发挥其结合抗原的能力。
IGHVH基因在另一个细微处也不同于IGHV区基因。IGHVH基因中通常包含特殊的序列(如Ig 识别信号序列的回文序列、七倍体类序列),这些基因被认为倾向于形成不均等DNA重组,基因转换或基因替换序列。以此推测这些基因元件引导基因更快的进化以更快的扩增IGHVH。此外,这些元件可能也负责B细胞受体的编辑。对于识别特异抗原的VHH通过后续的噬菌体展示经cDNA测序后发现相同的H3 loop(有相同的V-D-J重排)但是H1和H2 loop是不同的,不能排除是认为PCR所造成。
VHH和VH的另一个惊奇而又细微的差异是H1 loop。人和鼠的VH H1 loop中保守的Ala25,Gly27,Phe28,Phe30和Met39被认为是I型经典loop的结构。VHH胚系基因组,H1 loop Phe28(TTT)和Phe30(TTC)被Tyr密码子(TAT和TAC)替换。TAY碱基被认为是体细胞突变的热点碱基,这些密码子在VHH亲和成熟时会经常突变。而且,这一突变是VH H1 loop向N端loop延伸的主要原因,VH的H1 loop结构与人VH的H1 loop通常不同。
3.3 多样的VH基因有助于VHH库的形成
常规抗体的两个结合抗原的结构域首先经V-(D-)-J基因重排后组合而成,因此可以利用有限的基因实现多种可能的抗原结合结构。令人惊奇的是HCAbs虽缺乏VH-VL组合的多样性但其结合抗原的多样性与常规抗体相当。摩洛哥和阿拉伯国的两种单峰骆驼在不同时间免疫同一抗原后形成的VHH结构库比未免疫时更受限制,这些VHH经不同的IGHVH基因和J基因但相同的D基因组装而成。此外,二者的VHH中由D元件形成的loop结构有相同的抗原结合表面。但是,J和V基因元件显然经历了体细胞超突变。这一发现强调了这些抗体形成过程中亲和力成熟的体细胞突变和选择有重要作用。
VH或VL的数目提供了可能的抗原结合多样性。几年前,所有的IGHVHs基因属于IGHV3家族,是人和小鼠中丰富而广泛的家族,是功能性抗体形成所需要的。但是,近期发现羊驼中的胚系基因IGHV1和IGHV4基因被鉴定。这些基因被认为可以产生常规抗体的VH结构域。IGHV4也存在于单峰骆驼中,但是可以产生VH和VHH结构域。这些VHHFR3的疏水性弱。
同样的,IGHV3基因(FR2有疏水GLEW)也可以产生HCAbs。因此,GLEW结构域的IGHV3的骆驼可能也可经V-D-J重排后形成常规抗体或HCAb。实际上,HCAb库中已经分离了有GLEW结构域的类VH。一些类VH结构域缺乏由J基因编码的Typ118这一与VL互作的保守型氨基酸(图2)。但是,一些骆驼中D-J重排时发生核酸的插入或缺失,5’J基因处的Typ(TCG)可能被截断而变为AGG,CGG或 <






